1. Einleitung
Die Techniken Kryokonservierung und Revitalisierung sind
neben denjenigen der Embryogewinnung und des Embryotransfers die
methodischen Grundlagen einer Embryobank. Die Embryogewinnung und der
Embryotransfer finden aber auch Verwendung in anderen Zusammenhängen, die
über den Betrieb einer Embryobank hinausgehen.
Eine Embryobank, und auch einzelne ihrer Techniken, sind
u.a. nützliche Hilfen bei der Zucht von Nagern. So stellt z. B. der sterile
Embryotransfer eine Alternative zur Hysterektomie dar (Juhr, 1976;
Dagnaes-Hansen, 1988; Reetz et al., 1988; Spörri et al., 1988), da er ihr
gegenüber den Vorteil aufweist, daß postimplantatorische, vertikale
Erregertransmissionen beim Embryotransfer prinzipiell ausgeschlossen sind.
Konventionelle und kontaminierte Zuchten können durch sterilen
Embryotransfer in SPF-Zuchten überführt bzw. saniert werden.
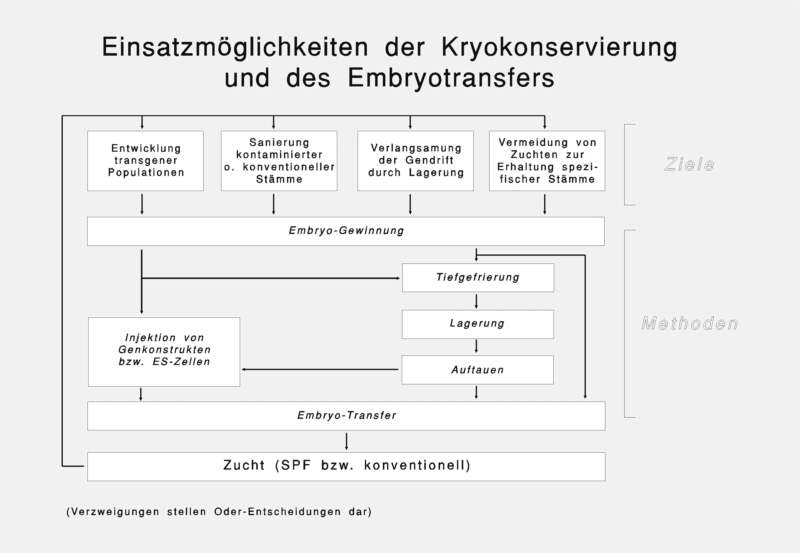
Große Bedeutung erlangen Kryokonservierung und Embryotransfer auch im
Zusammenhang mit der gentechnologischen Entwicklung transgener Tiere. Um
solche einmal entwickelten Tiere nicht durch aufwendige Zuchten erhalten zu
müssen, erweist sich die Kryokonservierung als hilfreiche, nicht zuletzt auch
ökonomische Methode zur Erhaltung diverser Genotypen. Dies gilt übrigens
auch für die zahlreichen Nagerstämme und ihrer Zuchtlinien. Bei diesen
ergibt sich durch die Möglichkeit der Kryokonservierung über viele Jahre
noch der Vorteil, die bei fortwährender Zucht natürlicherweise nicht zu
vermeidende Gendrift durch Revitalisierung von jahrelang kryokonservierten
Embryonen von Zeit zu Zeit wieder auszuschalten.
Für die Gewinnung von Embryonen und auch für den nach
der Revitalisierung auszuführenden Embryotransfer ist es von großer
Bedeutung auf gut geführte Zuchtpopulationen mit hohem hygienischem
Standard zurückgreifen zu können. Dabei stellt sich die Frage nach den
Erfolgsquoten. Das Problem ist, die konservierten Genotypen einerseits mit
hinreichender Sicherheit und andererseits mit minimiertem Aufwand zu
revitalisieren, zu transferieren und als zuchtfähige Linien schließlich
einsetzen zu können.
2. Literaturübersicht
2.1 Reproduktion und frühe Entwicklungsphasen der Maus
2.1.1 Ovulation
Überraschenderweise degeneriert mehr als die Hälfte
der primordialen Follikel, die bei der Geburt vorhanden sind, bevor die
Maus ein Alter von 3 - 5 Wochen erreicht hat. Es ist wenig über die
hormonalen und lokalen Faktoren bekannt, die diesen Vorgang steuern (Faddy
et al. 1983), was jedoch im Hinblick auf die Superovulation (siehe Kapitel
2.2.1 und 3.4.5) wünschenswert erscheint. Die weibliche Maus erreicht die
Geschlechtsreife mit ca. 6 Wochen je nach Stamm und äußeren Bedingungen
wie z. B. Futterrestriktion (Ball et al., 1947). Zu diesem Zeitpunkt
enthält jedes Ovar näherungsweise 104
Oozyten verschiedener Reifungsstadien.
Die Ovulation findet unter optimalen Laborbedingungen
ca. alle 4 Tage spontan statt. Dieser Zyklus kann jedoch durch viele
Umweltfaktoren (z.B. Hell-Dunkel-Phasen, olfaktorische Stimuli) und
Hormongaben beeinflußt werden. Speziell bei jungen Mäusen ist nicht
jeder Östrus von einer Ovulation begleitet (Togari, 1929); ebenso kann
Ovulation unabhängig vom Östrus auftreten (Young, 1941). Während eines
natürlichen Zyklus reagieren immer nur einige wenige Follikel auf das
körpereigene FSH der Maus und beginnen zu reifen. Der Follikel
akkumuliert Flüssigkeit, schwillt an und wandert zum Rand des Ovars,
bereit die Oozyte zu entlassen. Man bezeichnet ihn in diesem Zustand als 'Graafschen
Follikel'.
Die erste meiotische Teilung findet statt. Ein Satz
homologer Chromosomen wird, umgeben von etwas Zytoplasma als Polkörper
abgegeben. Nach dem Anstieg des körpereigenen LH-Levels wird die Oozyte,
etwa um die Mitte der Dunkelphase, entlassen.
Jede ovulierte Oozyte ist von der Zona pellucida und
Cumuluszellen, die mit Polyglykanen assoziiert sind, umgeben. Die Eizellen
werden durch die von den Zilien der inneren Epitheloberfläche erzeugten
Strömung in das offene Ende (Infundibulum) des Eileiters eingeschwemmt
und gelangen so in die Ampulla. Die Ampulla ist eine Ausweitung des
Eileiters, die nur in einer begrenzten Phase des Zyklus vorhanden ist.
Hier findet die Befruchtung der normalerweise 5 - 15 Eizellen statt. Die
Follikelzellen, die beim Ovar verblieben sind, bilden die Corpora lutea
(Gelbkörper). Sie helfen später mit die Trächtigkeit zu erhalten.
2.1.2 Befruchtung
Nach der Kopulation bildet sich der Pfropf, der für
meist 6 - 12 h sichtbar bleibt. Er besteht aus koagulierten
Spermabegleitstoffen und füllt die Vagina von der Zervix bis zur Vulva.
Der Pfropf ist ein sicheres Zeichen für eine stattgefundene Kopulation,
seine Voraussagekraft für eine zu erwartende Trächtigkeit ist jedoch
stark stammesabhängig. Bei MORO etwa ist bei 83 % und bei B6 nur bei 52 %
der Tiere mit Pfropf mit einer Trächtigkeit zu rechnen (Schnekenburger,
1983).
Bei der Ejakulation gelangen ca. 585-106
Spermien in den Reproduktionstrakt des Weibchens. Einige Spermien
erreichen die Ampulla schon nach etwa 5 min, sind aber vor Ablauf von 1 h
nicht fähig zur Befruchtung. Diesen Reifevorgang nennt man Kapazitierung.
Um die Oberfläche der Oozyte zu erreichen, muß das Spermium erst die
Cumuluszellen und dann die Zona pellucida durchdringen. Während der
Penetration findet
die akrosomale Reaktion statt: das Akrosom, eine sekretorische,
vakuolenartige Struktur im Spermienkopf, fusioniert mit der Plasmamembran
des Spermienkopfes und setzt verschiedene hydrolytische Enzyme frei. Ohne
akrosomale Reaktion kann das Spermium die Eizelle nicht befruchten.
Unbefruchtete Eizellen bleiben während ca. 12 h (Braden und Austin, 1954)
und Spermien für ca. 6 h (Merton, 1939) lebensfähig.
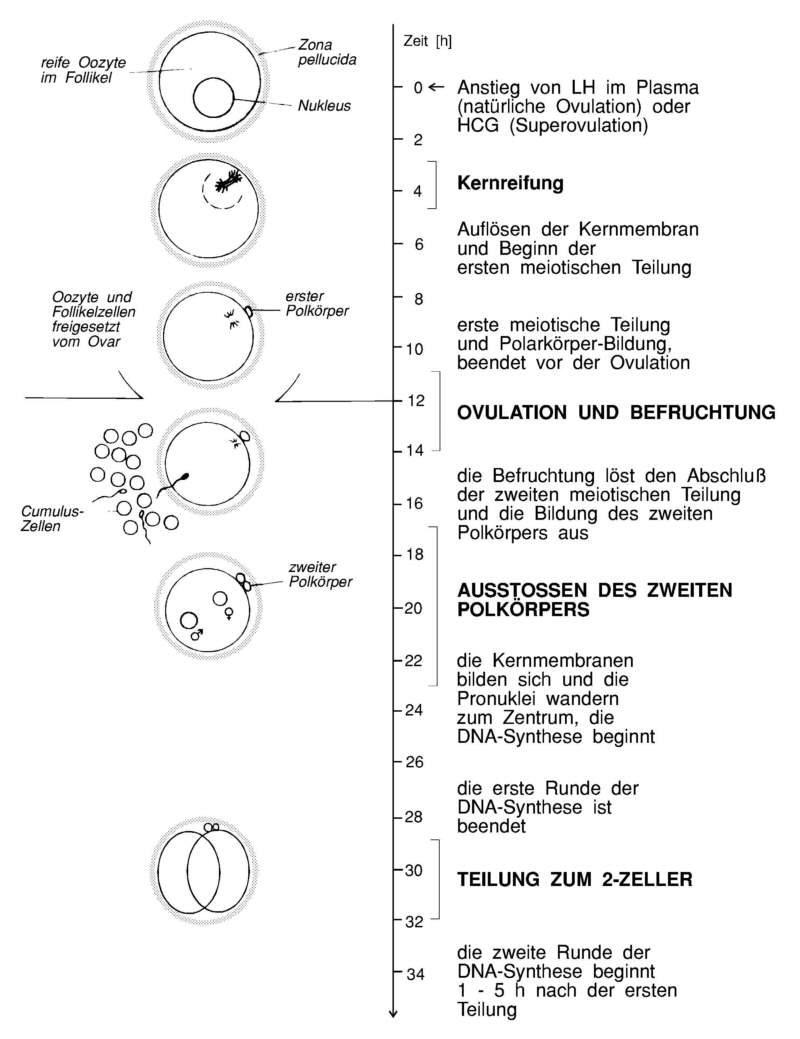
Die Fusion des hinteren Teils des Spermienkopfes mit der
Eizellen-Membran löst eine Folge von Reaktionen aus, die man als
Befruchtung bezeichnet. Eine der ersten Reaktionen ist eine Veränderung der
Oozytenoberfläche, die das Eindringen weiterer Spermien verhindert. Die
zweite meiotische Teilung findet statt, und der zweite Polkörper wird
gebildet. Die Kernmembranen bilden sich um die Chromosomen, und der haploide
männliche und weibliche Pronukleus wandern zur Mitte der Eizelle,
währenddessen die DNA-Replikation stattfindet. Die Membranen der Pronuklei
fusionieren nicht, sondern lösen sich auf, worauf bald die erste Teilung
erfolgt.
2.1.3 Präimplantationsstadien
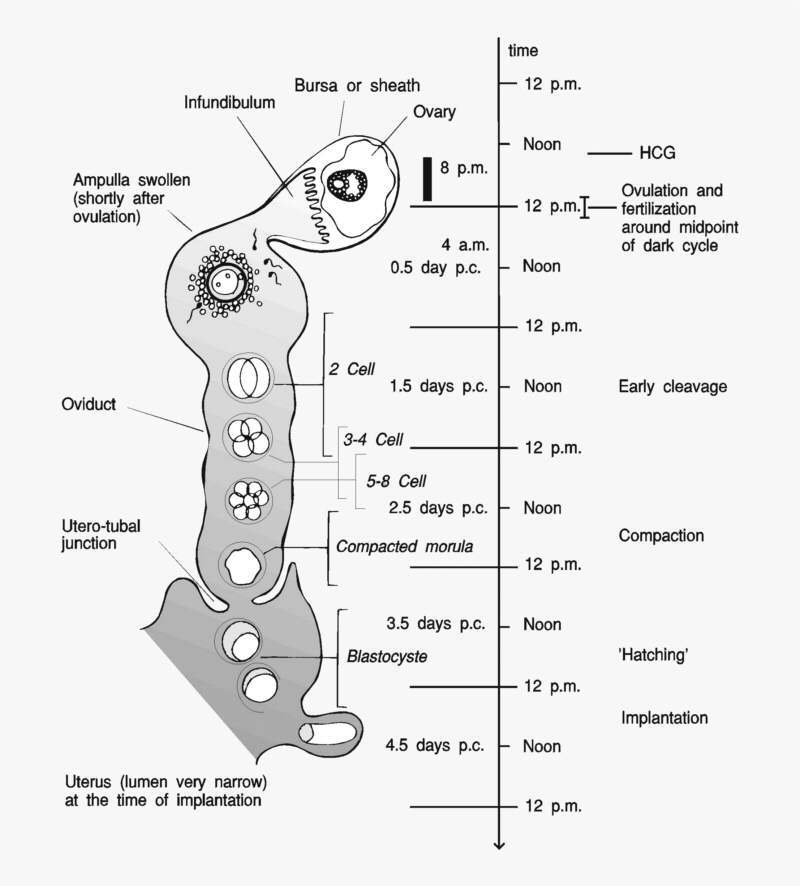
Wegen der asynchronen Ovulation und Fertilisation finden
die ersten Teilungen über mehrere Stunden verteilt statt. Die Blastomere
sind nicht immer gleich groß und teilen sich auch nicht immer synchron, so
daß Embryonen mit 3 oder 5 Blastomeren vorkommen können. Bis zum frühen
8-Zellstadium sind die Blastomere der Maus mit ziemlicher Sicherheit (Tarkowski,
1959) equipotent, was heißt, daß einzelne Blastomere sich zu einer
vollständigen Maus entwickeln können. Nach der Teilung zum 16-Zeller
lassen sich bereits zwei Zell-Linien unterscheiden: das Trophoektoderm und
die innere Zellmasse. Mit der Kompaktierung des Embryos steigt der Kontakt
der Blastomeren untereinander, es bilden sich Apikal- und Basalmembran und
die Blastomere entwickeln eine Polarisation. Diese Differenzierung endet
zunächst in der voll expandierten Blastozyste, bei der das Trophoektoderm
die innere Auskleidung eines flüssigkeitsgefüllten Hohlraumes (Blastozoel)
darstellt. Dieser Auskleidung liegt nach innen die innere Zellmasse auf.
Eine ausführliche Beschreibung der Kompaktierung und Diskussion der
Polarisierung findet man bei Gardner (1983), Johnson et al. (1981), Johnson
und Ziomek (1981) und Pratt et al. (1981).
Die vollständig expandierte Blastozyste enthält ca. 64
Zellen, von denen etwa 20 zur inneren Zellmasse zu rechnen sind. Während
des 5. Entwicklungstages schlüpft die Blastozyste, d. h. sie verläßt die
Zona pellucida, von der sie bis dahin immer noch umgeben war, und ist bereit
zur Nidation. Dieses Schlüpfen wird durch trypsinähnliche Enzyme
verursacht, die von Teilen des Trophoblast synthetisiert werden (Wassarmann
et al., 1984). Zur Zeit des Schlüpfens ist das Lumen des Uterus sehr klein,
so daß die Uteruswände aneinander liegen. Die Nidationsstellen sind nicht
vorbestimmt und die Verteilung der Embryonen wird durch die Peristaltik des
Uterus verursacht.
2.2 Embryogewinnung und -transfer
2.2.1 Superovulation
Bei der Superovulation imitiert man durch PMSG die
Wirkung des natürlichen FSH und durch HCG die des natürlichen LH. Dieses
Vorgehen bewirkt Einleiten des Zyklus und eine Erhöhung der Anzahl
reifender Follikel und damit auch der ovulierenden Eizellen. Diese Technik
wird bei vielen Spezies z. T. schon seit Jahrzehnten erfolgreich angewandt.
Die Superovulation erleichtert die Embryogewinnung
entscheidend. Da die Anzahl der Embryonen pro Tier sich um Faktoren zwischen
2-10 erhöht, ist der Einsatz dieser Technik für die Arbeitseffektivität
unabdingbar. Gleichzeitig werden wesentlich weniger Tiere als ohne
Superovulation benötigt, weshalb diese Technik auch vom Standpunkt des
Tierschutzes gesehen angewendet werden sollte.
Der Erfolg der Superovulation ist im wesentlichen von den
Faktoren Stamm, Alter des Tieres und Applikations-Zeitschema abhängig. Das
günstigste Alter für die Hormonbehandlung variiert von Stamm zu Stamm; Z.
B. CGa: 21 Tage (Gates, 1971), B6: 25 Tage (Hogan, 1986). Allgemein liegt es
zwischen 3 und 5 Wochen, was eine interessante Tatsache darstellt, da die
Tiere im Alter von 21 Tagen gerade abgesetzt werden und die Geschlechtsreife
erst im Alter von 6-7 Wochen eintritt. Nach dem Eintritt der
Geschlechtsreife nimmt die Sensitivität gegenüber der Superovulation
innerhalb von 1 - 2 Wochen schnell ab. Der Stamm B6 z. B. reagiert dann mit
diffusen Ergebnissen in Anzahl und Qualität der Embryonen, während bei
anderen Stämmen (z. B. B6D2F1)
Superovulation bis in ein Alter von etwa 8 Wochen durchaus sinnvoll ist.
Die Entwicklungsfähigkeit von nicht tiefgefrorenen
Mausembryonen, die von superovulierten Tieren gewonnen wurden, ist in vitro
gleich denen von normal ovulierten Embryonen (Gates, 1956; Vogel et al.,
1989). Reduzierte Entwicklungsfähigkeit von Embryonen, die im
hormonbehandelten Tier belassen wurden, führten Vogel et al. (1989) auf
maternale Faktoren zurück. Bei Kaninchen jedoch gibt es einen Hinweis, daß
Embryonen von superovulierten Spendern nach dem Tiefgefrieren eine
niedrigere Überlebensrate haben verglichen mit der von normal ovulierten
Embryonen (Reynard, 1979).
2.2.2 Embryotransfer
Die ersten Embryonen wurden von Heape (1890) am Kaninchen
übertragen. Heute ist der Embryotransfer ein Routineverfahren in vielen
Laboratorien und auch in der Landwirtschaft.
Im allgemeinen transferiert man Embryonen in
pseudoträchtige Empfängertiere (siehe Kapitel 3.6.2), obwohl durch
geschicktes Ausnutzen von Fell- und/oder Augenpigmentierung auch ein
Transfer in trächtige Empfängertiere möglich ist (z. B. Jean, R. and C.W.
Lo, 1990).
Bei den meisten Methoden erfolgt die Übertragung der
Embryonen auf chirurgischem Wege in den Eileiter (1-Zeller bis zur frühen
Morula) bzw. den Uterus (kompaktierte Morula, Blastozyste). Obwohl auch
'unblutige' Transfermethoden für Kleinnager (durch den Zervixkanal)
entwickelt wurden, so z. B. für Mäuse (Marsk und Larsson, 1974; Moler et
al., 1979) und für Ratten (Vickery et al., 1969), haben sich diese wegen
geringer Effizienz nicht durchgesetzt. Die 'unblutige' Vorgehensweise setzt
außerdem implantationsfähige Embryonen voraus, die in den Uterus
transferiert werden können. Sie ist also erst von der kompaktierten Morula
an bis zur Blastozyste einsetzbar.
Morulae können mit gutem Ergebnis in den Uterus von 2.5
Tage lang pseudoträchtigen Empfängertieren transferiert werden und
Blastozysten in solche Tiere, die am Tage 3 - 3.5 ihrer Pseudoträchtigkeit
stehen (Rafferty, 1970; Dickman, 1971). Alle frühen Teilungsstadien, von
der Zygote bis zur Morula, können in den Ovidukt von pseudoträchtigen
Empfängern transferiert werden. Bei dieser Technik benötigen die Embryonen
eine intakte Zona pellucida, was beim Uterustransfer nicht notwendig ist (Bronson,
1970).
2.2.3 Wechselwirkungen zwischen Embryo und Empfänger
Wechselwirkungen zwischen dem Empfängertier und den
transferierten Embryonen sind als immunologische Reaktionen beschrieben
worden. Embryotransfer bei Mäusen in allogener Kombination (Embryospender
und Embryoempfänger sind von verschiedenen Stämmen) ruft beim
Empfängertier eine Immunreaktion hervor. Diese ist stärker als eine
solche, die man bei semiallogenem Transfer (Embryospender oder
Embryoempfänger ist ein Hybrid des Embryospender-Stammes bzw. des
Embryoempfänger-Stammes) oder bei natürlicher Trächtigkeit durch ein
allogenes Männchen erhält. Beim transferierten Nachwuchs hingegen fand man
eine reduzierte immunologische Aktivität gegen Zellen der Ziehmutter (Cibotti
et al., 1986). Solche Effekte sind aber entgegen der Hypothese von Uphoff
(1972a; 1972b) als nicht erblich anzusehen (McCullagh, 1985). Vatev et al.
(1985) fanden schließlich eine Korrelation zwischen den höheren
Antikörperspiegeln von Empfängermäusen nach allogenem Transfer und
niedrigeren Implantationsraten. Diesen Befund stützt McCullagh (1985), der
eine reduzierte Überlebensrate
beim
Transfer von allogenen Rattenembryonen fand, woraus Hedrich und Reetz (1988)
den Schluß zogen, Embryonen auf möglichst nah verwandte Empfängerstämme
zu transferieren oder Hybridstämme (Hedrich and Reetz, 1990) dafür
einzusetzen, die den genetischen Background der zu transferierenden
Embryonen enthalten.
2.3 Kryokonservierungsmethoden für Embryonen
Die Originalmethode (Whittingham et al., 1972; Wilmut,
1972) beschreibt ein kontrolliertes langsames Einfrieren und langsames
Auftauen mit DMSO (Dimethylsulfoxid) oder Glyzerol als Gefrierschutzmittel.
Welche der nachfolgend beschriebenen Einfriermethoden man
verwendet, hängt von vielen Faktoren ab, häufig einfach von der
Laborausstattung und den gemachten Erfahrungen. Verläßliches Lagern und
Revitalisieren werden von einer Vielzahl Faktoren beeinflußt (z. B. Kühl-
und Erwärmungsrate, Medium, Gefrierschutzmittel, Lagertemperatur,
Entwicklungsstadium des Embryos, Stamm und Vorbehandlung des
Empfängertieres, Transfertechnik). Ihre Einzelfaktoren beeinflussen sich
auch gegenseitig. Daher können Veränderungen einzelner Schritte zu
unvorhergesehenen Ereignissen an anderer Stelle des Systems führen. Eine
etablierte Kryokonservierungs-Methode ist als Einheit zu sehen und kann nur
streng kontrolliert weiterentwickelt werden.
Eine interessante Variante, die jedoch keine praktische
Relevanz erlangte, beschreiben Storen et al. (1983), die, entgegen den
üblichen Gepflogenheiten, Mausembryonen erfolgreich noch im Ovidukt
befindlich tiefgefrieren und revitalisieren konnten. Man erspart sich so
etwas Aufwand beim Verpacken der Embryonen, hat jedoch keinen exakten
Überblick bezüglich der Anzahl kryokonservierter Embryonen und deren
Güte.
2.3.1 Kryoprotektiva
Da es bisher nicht gelungen ist, Embryonen ohne ein
Gefrierschutzmittel erfolgreich zu kryokonservieren, ist der Zusatz eines
Kryoprotektivums oder einer Kombination mehrerer Kryoprotektiva zum
Einfriermedium als notwendig anzusehen.
Die Kryoprotektiva werden traditionell in zwei Gruppen
eingeteilt, einerseits in zellpenetrierenden Substanzen (z. B.
1,2-Propandiol, DMSO, Glyzerin), die in multimolarer Konzentration geeignet
sind, lebende Zellen vor Tiefgefrierschäden zu schützen, und andererseits
in nichtpenetrierende Stoffe (z. B. Polyvinylpyrrolidon, Sucrose, Trehalose),
die, schnelle Einfrier- und Auftauraten vorausgesetzt, bereits in niedrigen
Konzentrationen (Meryman, 1971) kryoprotektiv wirken.
Der Schutzeffekt penetrierender Kryoprotektiva beruht
vermutlich auf einer Reduzierung der intra- und extrazellulären
Ionenkonzentration bei gleichzeitiger Gefrierpunktserniedrigung (Lovelock,
1953). Durch die Wasserbindungsfähigkeit penetrierender Gefrierschutzmittel
wird die Dehydrierung der Zellen vergrößert, so daß der Anstieg der
intra- und extrazellulären Ionenkonzentration auf einen kritischen Wert
erst in einem niedrigen Temperaturbereich stattfindet, in welchem
zellschädigende Prozesse verzögert ablaufen. Diesen Sachverhalt
postulierte Lovelock (1954) für Erythrozyten; Meryman et al. (1977)
bestätigten ihn.
Bei Untersuchungen an Mäuseembryonen stellten Leibo und
Mazur (1974) fest, daß DMSO und Glyzerin nicht unbedingt penetrieren
müssen, um eine ausreichende Kryoprotektion hervorzurufen. Ausgehend von
dieser Beobachtung folgerte Mazur (1980), daß penetrierende
Gefrierschutzmittel zusätzlich einen stabilisierenden Effekt auf die
Zellmembran ausüben.
Eine zellmembranstabilisierende Wirkung wird auch für
nichtpenetrierende Kryoprotektiva angenommen (Maurer, 1978; Mazur, 1970).
Meryman (1971, 1974) zeigte eine solche an Erythrozyten und Renard et al.
(1982) beim Ausverdünnen des Kryoprotektivums aus dem Medium
revitalisierter Rinderembryonen. Im Gegensatz zu den klassischen
Gefrierschutzmitteln DMSO und Glyzerin reicht ihre alleinige Anwendung
jedoch nicht aus, um ein Überleben der Embryonen während des Tiefgefrier-
bzw. Auftauvorgangs zu gewährleisten (Kasai et al., 1981; Wilmut, 1972).
Visintin et al. (1988) haben schließlich eine
synergistische Wirkung von Glyzerin (penetrierend) und Sucrose
(nichtpenetrierend) als Gefrierschutzgemisch bei Mausembryonen gefunden.
2.3.2 Einfriergeräte
Die Einfriergeräte lassen sich in zwei Gruppen
einteilen: die offenen Einfriergeräte und die Kammergefriergeräte.
Bei den offenen Einfriergeräten dienen verschiedene
Alkohollösungen, Trockeneis, flüssiger Stickstoff oder Kombinationen diese
Medien als Kühlmittel. Beim Einfrieren nutzt man z. B. die verschiedenen
Temperaturzonen des Kühlmittels aus und senkt das Gefriergut langsam in das
Kühlmittel ab, oder man benutzt ein Kühlaggregat. Der Vorteil dieser
offenen Einfriergeräte liegt, neben der guten Kontrolle, die man über das
Gefriergut hat (z. B. beim Seeding), in der Einfachheit und geringen Größe
der Geräte. Da, wie unten ausgeführt werden wird, für die
Dehydrierungsphase ein Temperaturbereich bis -30 °C genügt, sind offene
Systeme mit Alkoholbad und Kühlaggregat für die Kryokonservierung von
Embryonen ausreichend.
Bei den Kammergefriergeräten regelt ein Mikrocomputer
die Temperatur einer geschlossenen Kammer, die das Gefriergut enthält,
durch das Einblasen von Stickstoffdampf bzw. elektrisches Beheizen. Für den
Betrieb dieser Geräte benötigt man flüssigen Stickstoff in
Druckbehältern. Allgemein ist der Aufwand größer als bei den offenen
Einfriergeräten. Ein Vorteil des geschlossenen Konzeptes ist in der
größeren Menge zu sehen, die in einem Arbeitsgang eingefroren werden kann,
da die Kühlmitteloberfläche der offenen Geräte wegen des
Kühlmittelverlustes und der Wärmeaufnahme klein gehalten werden muß.
2.3.3 Einfriermethoden
2.3.3.1 Langsames Einfrieren und Auftauen
Kühlt man Embryonen langsam mit einer Rate von 0.3 - 0.8
°C/min bis
-80 °C, so wird der Embryo fortschreitend dehydriert, wodurch die Bildung
intrazellulärer Kristalle verhindert wird.
Das Originalprotokoll, wie es von Whittingham et al.
(1972) entwickelt wurde, ist eine handbetriebene langsame Einfriermethode,
die Dewarbehälter benützt. Als Gefrierschutzmittel dient DMSO mit einer
Molarität von 1.5 - 2. Die Embryonen werden bei 0 °C für 10 min
äquilibriert, in ein Kältebad (-6 °C) verbracht und nach 5 min findet das
Seeding (kontrollierte Auslösung der Kristallisation) statt, indem man das
Tube mit einem in flüssigem Stickstoff vorgekühlten Metallgegenstand
berührt. Nach einer weiteren Äquilibrierungszeit von 5 min werden die
Tubes in einer mit flüssigem Stickstoff gekühlten Kammer plaziert, die auf
-6 °C vorgekühlt wurde. Die Temperatur wird dann konstant mit 0.5 °C/min
auf -80 °C abgesenkt. Nach Abschluß dieser Phase werden die Tubes sofort
in flüssigen Stickstoff überführt und gelagert.
Das Auftauen muß, im Vergleich zu anderen
Einfriermethoden, langsam mit einer Rate von ca. 8 °C/min vor sich gehen,
um dem Embryo Zeit zu lassen, sich zu rehydrieren (Whittingham, 1981).
2.3.3.2 Schnelles Einfrieren
Im Gegensatz zur ursprünglichen Ansicht, daß Embryonen
die Lagerung bei -196 °C nur nach langsamem Abkühlen bis -80 °C
überleben, hat sich gezeigt, daß Embryonen, schnelles Auftauen
vorausgesetzt (100 - 300 °C/min) auch schnelleres Einfrieren tolerieren,
obwohl sich im Inneren dieser Embryonen, wegen der zu geringen Dehydrierung
Eiskristalle bilden (Rall, 1981).
Embryonen, die mit verschiedenen dieser schnellen
Methoden eingefroren wurden, sind vermutlich in einem metastabilen Zustand.
Nach Leibo (1981) können minimale Veränderungen beim Auftauen und
Ausverdünnen der Gefrierschutzmittel ungeahnte Folgen haben. Ebenso wurde
festgestellt, daß die Lagertemperatur für Embryonen, die schnelles
Auftauen verlangen, unbedingt bei -196 °C gehalten werden muß. Im
Unterschied dazu sind langsam eingefrorene Embryonen weniger empfindlich
gegenüber der Lagerung bei etwas 'höheren' Temperaturen (Rall et al. 1980;
Rall, 1981) und können daher auch mit Trockeneis gekühlt transportiert
werden (Whittingham, 1981), was einer Temperatur von -79 °C entspricht.
Lagerung und Transport bei höheren Temperaturen bedeutet immer einen
Vorteil, da dies mit weniger apparativem und finanziellem Aufwand verbunden
ist.
2.3.3.3 Zweischritt-Methode
Bei dieser Methode werden Embryonen langsam mit einer
Rate von ca. 0.4 °C/min bis in einen Temperaturbereich von -30 bis -40 °C
abgekühlt und anschließend in flüssigen Stickstoff überführt (z. B.
Willadsen, 1977). Diese Methode ist weniger zeitaufwendig, verbraucht
weniger Stickstoff oder kommt sogar ganz ohne ihn aus, da die angesprochenen
Temperaturbereiche auch mit Alkohol-Kryostaten erreicht werden können. Die
Zweischritt-Methode ist schneller, einfacher und billiger.
Es wurden verschiedene Varianten dieser Methode
beschrieben, die vor allem in der Wahl des Gefrierschutzmittels, der
Seedingmethode, Länge und zeitlicher Anordnung der Äquilibrierungsphasen
sowie der Apparatewahl und in Feinheiten des Temperatur-Zeitschemas
differieren (z. B. Hedrich and Reetz, 1990; Miyamoto and Ishibashi, 1986;
Wood, 1980).
2.3.3.4 Vitrifikation
Mehrere Arbeitsgruppen haben berichtet, daß Maus- und
Rattenembryonen direktes Einfrieren in flüssigem Stickstoff überleben
können (Biery et al., 1986; Chupin and DeReviers, 1986; Hedrich and Reetz,
1990; Krag et al., 1985; Rall and Fahy, 1985; Takeda et al., 1984; Williams
and Johnson, 1986). Diese schnelle Einfrier - schnelle Auftau-Methode setzt
hohe Konzentrationen von Gefrierschutzmitteln in wäßriger Lösung voraus.
Bei einer bestimmten Temperatur unter 0 °C werden diese Lösungen viskos
und treten, ohne Eiskristalle zu bilden, in eine amorphe Phase über. Die
meisten Arbeitsgruppen benutzten eine Kombination von Glyzerol (3.0 - 4.0 M)
als penetrierende und Sucrose (0.25 - 1.0 M) als nichtpenetrierende
Gefrierschutzmittel. Vor dem Einfrieren müssen die Embryos dehydrieren. Bei
Temperaturen unter 4 °C halten die Embryonen solche konzentrierten
Lösungen von Gefrierschutzmittel und die Dehydrierung aus (Rall and Fahy,
1985).
Obwohl diese Methode keinerlei Apparatur für den
Einfriervorgang benötigt und daher durch ihre Einfachheit besticht, konnte
sie bisher noch nicht die konventionellen Methoden ersetzen. Der Grund
hierfür dürften die stark streuenden Erfolgsraten sein, wie sie z. B.
Mendes da Cruz (1989) beschreibt.
2.4 Embryobanken
In der biomedizinischen Forschung besteht zunehmend
Bedarf an genetisch spezifizierten Kleinnagerstämmen. Die Erhaltung eines
derart umfangreichen Stammangebotes durch Zucht, insbesondere bei nur
gelegentlichem Bedarf solcher speziellen Stämme, ist mit großem
Pflegeaufwand, Material- und Raumbedarf verbunden. Dies wird besonders
deutlich bei Stämmen, die regelmäßiger Applikation von Medikamenten
bedürfen (z. B. spontan diabetische Ratten).
Eine Embryobank bietet die Möglichkeit, diesen Aufwand
stark zu reduzieren und bewahrt gleichzeitig den Genpool eines einzelnen
Stammes sowie die Verfügbarkeit vieler verschiedener und spezieller
Stämme.
Die eingefrorenen Stämme stellen generell eine Reserve
dar, aus der heraus verlustig gegangene Stämme (z. B. nach
mikrobiologischer bzw. genetischer Kontamination) schnell saniert bzw.
regeneriert werden können.
Ferner kann die unvermeidliche Gendrift bei
Inzuchtstämmen durch Revitalisierung kryokonservierter Embryonen nach einer
bestimmten Anzahl Generationen wieder rückgängig gemacht werden, was der
Forderung nach genetisch standardisierten Versuchstieren entgegenkommt.
Einen möglichen Weg unter Einsatz der Kryokonservierung beschrieb Hedrich
(1980).
Zunehmende Bedeutung gewinnt die Kryokonservierung für
die Lagerung transgener Stämme. Bei der wachsenden Anzahl genmanipulierter
Populationen würde das kontinuierliche Züchten all dieser Variationen zur
Erhaltung des modifizierten Genpools sehr aufwendig.
2.4.1 Minimalzahl einzufrierender Embryonen
Die minimal einzufrierende Embryonenzahl hängt ab von
der Effektivität und Sicherheit des Einfrier-Revitalisierungs-Systems, dem
Einfrierzweck und nicht zuletzt vom Sicherheitsbedürfnis.
Bei der Effektivität ist nicht nur die Auftauquote,
sondern der gesamte Ablauf bis zum Absetzen der Jungtiere zu
berücksichtigen, da maternale Faktoren zu starkem Verlust von morphologisch
intakt aufgetauten Embryonen nach dem Transfer und auch noch nach dem Wurf
führen können. Friert man Embryonen mit dem Ziel ein, die Gendrift eines
Inzuchtstammes zu verlangsamen, so müssen dafür die Auftauintervalle und
deren gewünschte Anzahl bekannt sein. Da es sich um ein biologisches System
handelt, bei dem mit großen Erfolgsschwankungen und unvorhergesehenen
Effekten zu rechnen ist, sollte immer ein Mehrfaches der im ungünstigsten
Fall notwendigen Embryonen tiefgefroren werden.
Um eine Inzuchtpopulation zu reetablieren sind 5
Zuchtpaare als ausreichend anzusehen. Bei Auszuchtstämmen ist eine ungleich
größere Anzahl notwendig, müssen doch alle Zuchtgruppen oder
Auszuchtlinien in der reetablierten Population in angemessener Zahl
vertreten sein, um einen Heterogenitätsverlust zu vermeiden.
Die für notwendig erachtete Minimalzahl für die sichere
Reetablierung eines Inzuchtstammes variiert von 500 Embryonen (Jackson
Laboratory, Bar Harbor, USA (Mobraaten, 1981), Institute of Molecular
Genetics, Prag, CR (Boubelik, 1988), MRC, Surrey, GB (Wood, 1981)) über 300
Embryonen (BRL, Füllinsdorf, CH (Schröder, 1989)) bis zu 200 Embryonen (ZFV,
Hannover, D (Hedrich and Reetz, 1990)).
Bei Auszuchtstämmen ist die für homozygote Embryonen
kalkulierte Zahl mit einem Faktor, der der Anzahl Zuchtgruppen entspricht,
zu multipliziere.
2.4.2 Langzeitlagerung von tiefgefrorenen Embryonen
Seit es gelungen ist, Embryonen revitalisierbar
tiefzugefrieren, steht die essentielle Frage nach der Stabilität
tiefgefrorener Embryonen während ihrer Lagerzeit bisher noch nicht
zufriedenstellend beantwortbar im Raum. Dieses Problem wurde von Mazur
(1974) diskutiert, und Lyon et al. (1977, 1981) konnten einen Beitrag zu
ihrer Beantwortung leisten.
Bei -196°C laufen weder normale chemische Reaktionen ab,
noch existiert flüssiges Wasser. Wir haben es mit kristallinen oder
glasartigen Strukturen zu tun, deren Viskosität sehr hoch ist, so daß
Diffusion praktisch nicht stattfindet. Die thermische Energie und die
molekulare Bewegungsenergie sind ebenfalls sehr gering. Die einzigen
beachtenswerten Reaktionen in einem solchen System sind photophysikalischer
Natur: die Bildung freier Radikale und Brüche in Makromolekülen durch
ionisierende Hintergrundstrahlung oder hochenergetische Teilchen. Daraus
entstehende Schäden akkumulieren sich zweifellos mit der Zeit, da in
gefrorenem Zustand die Reparaturmechanismen, wie der gesamte Embryo
lahmgelegt sind.
Bei Schätzungen mutagener Reaktionen geht man davon aus,
daß ca. 1 % der unter normalen physiologischen Bedingungen vorkommenden
Mutationen durch natürliche Strahlung hervorgerufen werden. Nimmt man
weiterhin an, daß die Reparaturmechanismen nach dem Revitalisieren schnell
wieder in Gang kommen, so ist erst nach Jahrzehnten Lagerzeit mit dem
Anstieg von Mutationen im Vergleich zum physiologischen Background zu
rechnen (Mazur, 1976).
Lyon et al. (1981) fanden nach 5 Jahren Lagerzeit kein
Absinken der Revitalisierbarkeit im Vergleich mit Embryonen, die nach 24 h
Lagerzeit schon revitalisiert wurden. Bei simulierten
Background-Strahlungsdosen von 10 und 100 Jahren Lagerzeit konnten ebenfalls
keine nachteiligen Wirkungen auf die Revitalisierbarkeit festgestellt
werden.
Abschließend beantworten läßt sich die Frage nach der
Stabilität der tiefgefrorenen Embryonen jedoch erst in der Zukunft, wenn
genügend Embryonen zur Verfügung stehen, die längere Zeit gelagert worden
sind.


