TAVOLA
PERIODICA DEGLI ELEMENTI
La costruzione della Tavola Periodica di Dimitry Mendeleyev
L'obiettivo, ambizioso per altro, di questa
lezione consiste nel condure l'allievo fino alla Tavola
Periodica degli Elementi che consiste in un elenco degli elementi
noti ordinati nel periodo 1868-70 da Dimitry Mendeleyev
e Lothar Meyer, indipendentemente uno
dall'altro, in una tabella basata su due criteri: a)
l'aumento del peso atomico e b) raggruppamento
secondo proprietà chimiche e fisiche comuni o simili. Una
volta scoperrto il modo di assegnare delle masse atomiche realtive agli
atomi dei diversi elementi, il geologo francese Alexandre-Emile
Béguier de Chancourtois (1820-86),
dopo aver ordinato tutti gli elementi per massa atomica crescente in un
colonna, pensò di piegare a forma di clindro il foglio di carta
con la sua lista in modo da poter creare dei gruppi di elementi con proprietà
simili. Una scoperta fondamentale proviene da John
A. R. Newlands (1837-98) che si accorse come gli elementi dalle
proprietà simili si ripetevano ogni
7-8 posizioni nell'elenco secondo il peso atomico, così come nella
scala musicale l'ottava nota in serie assomiglia alla prima. Egli formulò
questa legge come la Legge dell'Ottava. Un
esempio: dall'idrogeno (l'atomo più leggero) al neon il peso atomico
aumenta da 1.008 a 20.179 dalton, ma è indubbio che l'elio (Nr 2)
e il neon (Nr 10) sono molto simili per proprietà chimiche e fisiche
(gas incolori, inodori, inerti, emettono luce sotto scarica elettrica,
dalla densità bassa) e andrebbero raggruppati insieme all'argo (Nr
18 nella Tavola). Così la Legge dell'Ottava
di Newlands è evidente: gli elementi Nr 2, 10 e 18 sono molto simili
e formano il gruppo dei gas nobili! In modo
analogo gli elementi mostrati nella primissima lezione, Nr 3 litio, Nr
11 sodio e Nr 19 potassio sono molto simili tra di loro (chimica, vedi
reazione violenta con l'acqua, densità, aspetto esteriore) e fanno
parte del gruppo dei metalli alcalini. Anche
qui la legge di Newlands si fa notare (Nr 3-11-19). Questa idea spinse
il chimico russo Dimitry Mendeleyev e quello tedesco Lothar Meyer ad ordinare
i 63 elementi conosciuti in una grande tabella con il peso atomico che
aumenta in ogni riga da sinistra a destra cominciando dall'idrogeno e con
gli elementi simili tra di loro posti in colonne verticali. Nelle prime
righe del sistema la legge dell'ottava è rispetatta, ma poi non
vale più, poiché essa è un caso
speciale di una legge fondamentale e rimasta sconosciuta fino ai lavori
di E. Rutherford e Niels Bohr.
 |
|
In questo modo Mendeleyev descrisse gli elementi eka-boro ed eka-silicio (chiamati poi alluminio e germanio quando vennero scoperti) con rispettabile precisione. Per esempio, per l'eka-silicio (dal sanskrito: il primo dopo il silicio, s'intende nella colonna della tabella) la previsione fu: 72 dalton per la massa atomica, densità 5.5 g/cc, formula dell'ossido XO2, densità dell'ossido 4.7 g/cc ecc. Questo elemento venne scoperto in Germania (chiamato germanio, simbolo Ge) ed aveva le proprietà: 72.59 dalton, 13.6 g/cc, GeO2 con 4.23 g/cc !!
1 dalton = 1 AMU (unità di massa atomica) = 1.66057 x 10-24 grammi
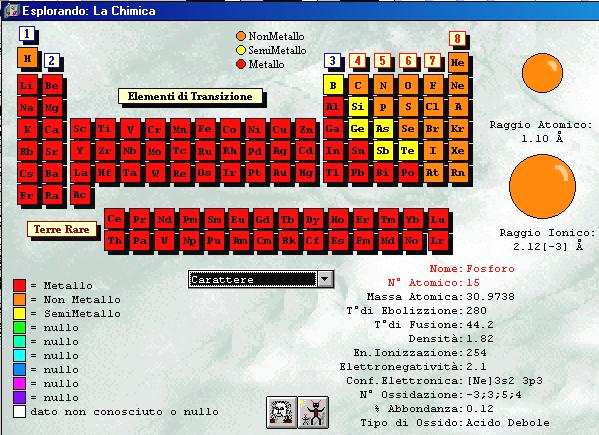
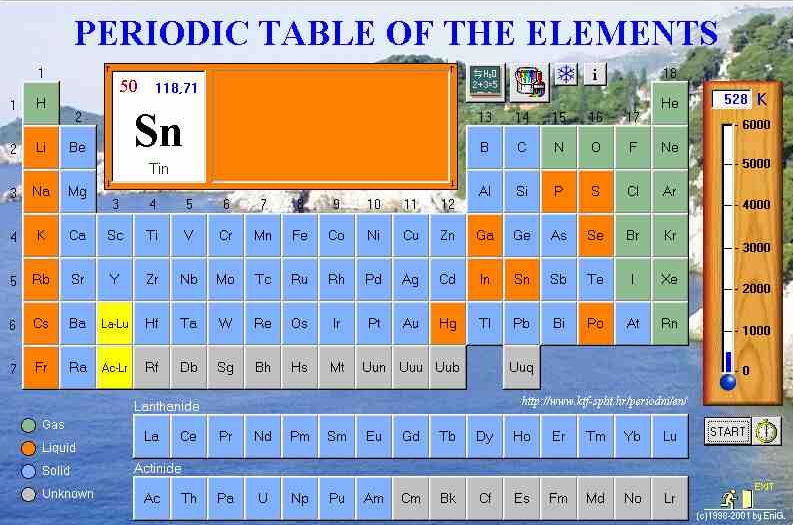
Sulla rete si possono
consultare diverse tavole periodiche ricche di informazioni, per esempio:
http://www.webelements.com/ (ottimo, in
inglese come tutto il resto!)
http://chemlab.pc.maricopa.edu/periodic/periodic.html
http://www.superdeluxe.com/elemental/ (per
poesia e chimica!)
 |
 |
Adesso si può aggiungere un altro dato che collega Dalton a Mendeleyev: le colonne della Tavola di Mendeleyev contengono elementi che hanno in comune buona parte delle valenze ottenibili dalle leggi di Dalton e Proust (chimica simile!).
In conclusione il vero
principio ordinatore di una tabella,
la quale metta in evidenza proprietà chimiche e fisiche comuni tra
elementi diversi, dipende dalla struttura interna
degli atomi (vedi prossima lezione), ma le leggi di Dalton
(atomismo e combinazioni), Lavoisier,
Proust,
Boyle,
Gay-Lussac,
Avogadro
o Charles permettono già enormi progressi
nella comprensione della chimica e sono alla base
dello studio tradizionale della materia !
|
|
|
PREVIOUS |
|
PHOTO GALLERY |
|
Last updated: Feb 2002!