ELEMENTI
& ATOMI
I lavori
di Robert Boyle, Antoine Lavoisier, John Dalton e Joseph L. Proust, fino
alla
Tavola Periodica di
Dimitry Mendeleyev (periodo 1650-1880).
Il periodo dell'Alchimia durò, si può dire, in cifra tonda 2000 anni: dalla morte di Aristotele nel 322 a.C. fino alla pubblicazione del trattato di Robert Boyle, "The Sceptical Chymist", nel 1661 ! Alcuni momenti vanno ricordati come curiosità storico-culturali:
Il primo trattato alchimico in Europa occidentale risale al 1144 per mano di Robert of Chester che compose "De compositione alchemiae". Nei decenni seguenti alcuni manuali arabi - basati in parte su conoscenze dell'antichità greca, egizziana e persiana - vennero tradotti in latino. Il vescovo di Regensburg, Albertus Magnus, pubblicò nel 1264 "De mineralibus" e Ramon Lull con "Ars magna" un un'opera emblematica dell'epoca dieci anni dopo. Una bolla papale (Giovanni XXII) contro la contraffazione chimica risale al 1317 e curiosamente il medesimo Papa fece costruire un laboratorio per un "certo lavoro segreto" 13 anni dopo! Non di meno, nel 1376, il Manuale degli Inquisitori elenca gli alchimisti tra i maghi e gli stregoni, tanto da rendere illegali esperimenti del genere in tutta l'Europa cristiana. I secoli XV e XVI videro l'opera di personaggi ormai mitici come Avicenna e Geber (al secolo Jabir ibn Hayyan al Razi), Georgius Agricola Bermannus (scrisse un libro sull'estrazione di metalli preziosi) e Agrippa (3 libri sulla filosofia occulta), Andreas Libavius ("Alchymia") e Paracelso, in un alternarsi di lavori concretamente utili (metallurgia, minerali, pirotecnica) e metafisici (magia, cabalistica, arte occulta).
Dopo aver introdotto il tema dell'Alchimia, la quale, seppur con obiettivi metafisici, aveva portato i ricercatori a moltiplicare le conoscenze pratiche della materia e delle sue reazioni nonché delle tecniche di purificazione, e prima di entrare nell'Era Moderna della Chimica come scienza speriementale e teorica nel vero senso della parola, bisogna ricordare ancora un personaggio famoso e curioso: il medico, alchimista e filosofo svizzero Paracelso, al secolo Philipp Theophrastus Aureolus Bombastus Paracelsus von Hohenheim (1493-1541), fondatore della iatro-chimica (chimica a scopo medico). Pur credendo personalmente nella trasmutazione dei metalli e nella pietra filosofale, Paracelso fu il primo a dare una nuova direzione alla scienza alchimica: metodi e ricette, lotta alle malattie, obiettività negli esperimenti chimici.
 |
|
Boyle, costruitosi un laboratorio nel 1649 a casa sua, si immerse nel lavoro sperimentale e descrisse chiaramente miscugli, sostanze pure, composti ed elementi, studiò le combustioni e i gas, si valse di metodi scientifici nelle sue indagini e giunse a conclusioni razionali dopo aver riconsiderato tutto l'insieme di dati prodotti nel passato! Per la prima volta compare una concisa definizione di elemento chimico come sostanza non scomponibile in altre più semplici con i mezzi dell'analisi chimica.
Nella seconda metà del secolo XVIII le scoperte si moltiplicano grazie al lavoro di tutta una schiera di chimici, ormai si può usare questo termine, come J. Priestley (scopre l'ossigeno), C. W. Scheele (anche lui l'ossigeno), S. Hales (tecniche per manipolare gas), J. Black (scopre l'anidride carbonica), H. Cavendish (l'idrogeno). Grande influsso ebbero anche Nicolas Leméry (1645-1715) e Nicolaas Hartsoeker (1656-1725), i quali, per spiegare le reazioni chimiche, avevano introdotto il concetto di particelle di materia dotate di forme specifiche con per altro immaginosi ed invisibili meccanismi particellari. In ogni caso l'atomismo degli antichi Democrito ed Epicuro stava dominando la scena: si andava dalla ristampa (1473 e 1486) del famoso poema "De rerum natura" di Tito Lucrezio Caro fino agli scritti del filosofo Francis Bacon (1623). Bisogna segnalare che una delle componenti avverse ai progressi della chimica, la Chiesa cristiana, derivava il suo credo anti-atomistico dalle tesi di St. Agostino (354-430), avendo elevato il pensiero di Aristotele allo stesso livello delle Sacre Scritture, così come aveva fatto con il lavoro di Tolomeo in astronomia (geocentrismo).
Le idee di Daniel Sennert (1572-1637) ispirarono Robert Boyle. Vissuto all'epoca di due giganti intellettuali come René Descartes (1596-1650), il quale riteneva i corpuscoli della materia divisibili in infinito, e Francis Bacon (1561-1626), Sennert pensava che dovevano esistere atomi di pù di un tipo, capaci di unirsi per formare i corpi composti e si serviva di esperienze pratiche per sostenere le sue tesi (gli atomi dovevano essere piccolissimi per poter penetrare 4 strati di carta nel caso dei vapori del vino, mentre un grande volume di vapore poteva condensare in una sola goccia di liquido). Inoltre, gli atomi mantenevano la loro forma e le loro proprietà: oro ed argento puri si mischiano completamente se fusi, ma trattando il miscuglio con acido nitrico, questo dissolve solo l'argento, lasciando, l'oro puro intatto.
Sembra che il vero inizio del
pensiero atomistico sia tracciabile all'invenzione del barometro
nel 1634 da parte di Evangelista Torricelli: sopra la colonnina
di mercurio e sotto il vetro si formava il vuoto! Ebbene una delle
conclusioni fondamentali di Aristotle, poi sposata dalla Chiesa, era l'inesistenza
del vuoto. Torricelli e Otto von Guericke (pompa
ad aria, 1654) inflissero con le loro scoperte un duro, benché
non definitivo, colpo a simili teorie. Pierre Gassendi (1592-1655)
contribuì invece con i suoi scritti (3 volumi di Syntagma philosophiae
Epicuri) a rendere più popolare l'atomismo e a disgiungerlo
dall'ateismo tramite l'idea che gli atomi debbano la loro creazione
e il loro movimento a Dio. L'importanza va collegata alla
decisione del parlamento di Parigi nel 1624 di punire con la pena di morte
chiunque insegnasse teorie contrarie ad Aristotele (atomismo compreso).
 |
|
 |
|
 |
|
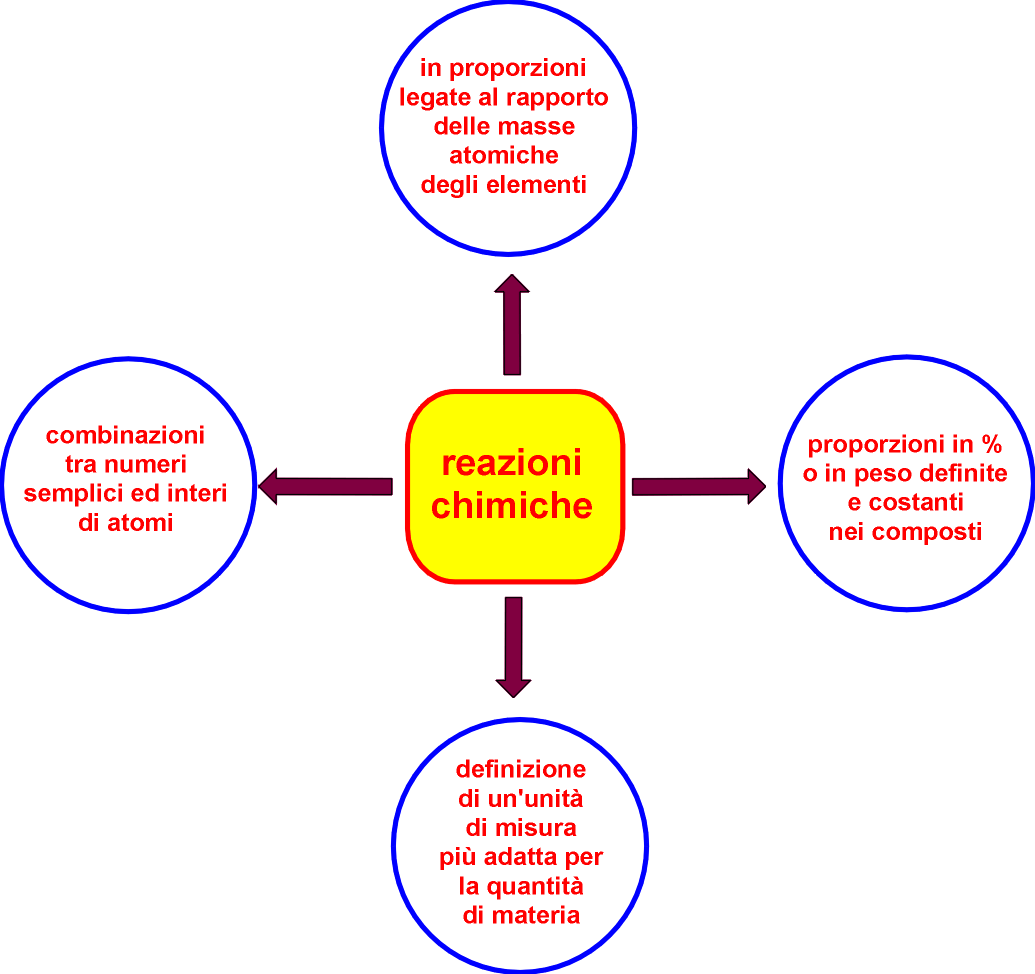
Lavoisier espose le sue idee nel suo Trattato elementare di chimica (1789), idee che vennero poi riprese da John Dalton. In particolare, il ricercatore francese fu il primo ad analizzare obiettivamente i risultati di generazioni di chimici e tirarne fuori le conclusioni decisive per lo sviluppo della chimica come scienza indipendente. Egli non fu un grande scopritore di nuove reazioni o elementi, bensì un preciso ed attento sperimentatore. Nessuno fino ad allora si era mai accorto che la reazione di un metallo con l'ossigeno produceva una nuova sostanza di peso maggiore equivalente alla somma dell'ossigeno consumato e del metallo utilizzato. In un sistema isolato si scopre la legge della conservazione della massa: durante la reazione il peso totale del sistema resta costante!
Le leggi di Lavoisier
tramite il modello di J. Dalton per la reazione tra il calcio
(40.08 g, 4 palline verde-grigio) e l'ossigeno puro (16 g, gas incolore),
reazione mostrata in laboratorio (vedi capitoli precedenti), in un sistema
chiuso (senza altri gas oltre l'ossigeno con la tara sottratta dal peso
sulla bilancia):
 |
 |
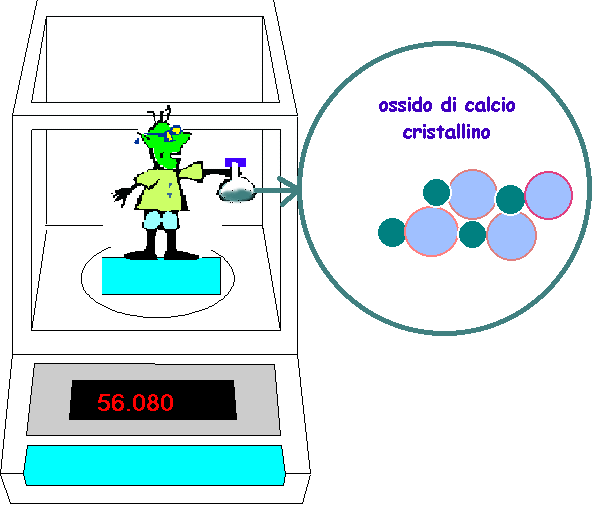
Durante la reazione (immagine intermedia
sopra), se il sistema chiuso regge, la massa totale delle sostanze presenti
nel pallone di vetro resta costante. Alla fine l'ossigeno è stato
consumato completamente in questo esperimento fittizio e si ritrova legato
agli atomi del calcio nel prodotto della reazione!
 |
|
Il lavoro di Proust è simile a quello
del ricercatore francese Gay-Lussac che aveva trovato la stessa idea per
i volumi nelle reazioni dei gas.
Applichiamo la legge di Proust delle proporzioni
definite nell'esempio precedente. L'elemento calcio (un metallo, benché
di aspetto terroso) reagisce completamente (al 100%) con l'ossigeno (un
non-metallo) nel rapporto di 40.08 a 16.00 grammi per dare 56.08 grammi
dell'ossido di calcio. Facendo l'analisi chimica (elementare) di questo
ossido troveremo sempre un contenuto di 71.47 % di calcio e 28.53 % di
ossigeno, senza che la provenienza o il modo di preparazione abbiano un
effetto. Il quoziente delle masse atomiche del calcio e dell'ossigeno (40.08
dalton : 15.9994 dalton) equivale a 2.505, ed è perfettamente uguale
al quoziente delle percentuali di composizione di questo prodotto (71.47
% : 28.53 %).
Perciò, la
proporzione che descrive questa reazione è la seguente: il calcio
reagisce al 100% con l'ossigeno nel rapporto di 40.08 g di calcio per 16.00
g di ossigeno, o nella proporzione di un atomo di calcio (40.08 dalton)
per ogni atomo di ossigeno (15.999 dalton). Questa legge si lascia esprimere
anche con un linguaggio più matematico (vedi lezione).
 |
|
|
|
|
 |
e mercurio rame, carbonio, stagno,
nickel
platino, zolfo, arsenico
e
acqua, sale, acido,
aceto, olio
|
|
|
|
|
|
 |
carbonio azoto ossigeno fluoro antimonio argento arsenico ferro manganese mercurio oro piombo rame stagno zinco zolfo fosforo potassio sodio |
5.4 5.0 8.0 -- 40.0 90.0 21.0 25.0 25.0 84.0 60.0 90.0 56.0 52.0 29.0 13.0 9.0 -- -- |
12.001 14.006 15.999 18.990 121.750 107.868 74.921 55.847 54.938 200.590 196.967 207.190 63.540 118.690 65.357 32.065 30.974 39.102 22.980 |
Dalton nacque ad Eaglesfield (Cumberland) e divenne prima maestro di matematica e filosofia naturale, poi professore di chimica e presidente della Società Filosofica Inglese fino alla sua morte a Manchester nel 1844. Al suo funerale accorsero ben 40 000 persone. Lo studio della pressione di vapore, della solubilità dei gas e dei loro miscugli permise a Dalton di formulare la sua ipotesi atomica. L'idea delle proporzioni definite proviene da Proust, ma Dalton scoprì poi la legge delle proporzioni multiple nel caso di elementi che formano più composti tra di loro (ossigeno ed azoto formano tra di loro ben 5 ossidi diversi, di cui alcuni stabili).
La legge della conservazione
della massa venne confermata e il fulcro di una reazione così espresso:
"All
the changes we can produce, consist in separating particles that are in
a state of cohesion or combination, and joining those that were previously
at a distance".
A New System of Chemical
Philosophy, 1808-10.
John Dalton fu il primo a proporre un sistema internazionale di simboli semplici per gli elementi (ormai una buona 30ina) e soprattutto una lista delle masse atomiche. Per molto tempo e ancora oggi nel campo della biochimica (misurazione di proteine e DNA) l'unità del peso atomico viene chiamata "Dalton" invece di AMU (atomic mass unit). Il suo nome è legato anche alla malattia che lo tormentò ed egli descrisse, il daltonismo, nel suo caso del tipo rosso-verde (Extraordinary Facts Relating to the Vision of Colors, 1794).
Importante è segnalare che il chimico italiano Cannizzaro aveva mostrato come il volume di un gas fosse, a temperatura, quantità e pressione costanti, solo una funzione del numero delle particelle mobili che lo componevano: questa scoperta permise di introdurre la prima scala dei pesi atomici relativi, assegnando il valore di 1 (unità definita: AMU o Dalton) arbitrariamente all'atomo senz'altro più leggero che esista, l'atomo d'idrogeno, e studiando il paragone con volumi uguali degli altri elementi gassosi!
Per concludere applichiamo l'ipotesi atomica di Dalton all'esempio proposto prima (reazione tra calcio ed ossigeno). Gli atomi di calcio erano legati uno all'altro nel cristallo di questo metallo. Il calore fornito per far scattare la reazione è servito a disgiungerli e rompere il cristallo. Adesso 4 atomi di calcio liberi si scontrano con 4 atomi di ossigeno e si legano con loro solo in proporzioni di numeri semplici e interi come 1:1 (è il nostro caso), 2:1 o 1:2 e così via. La reazione ha unito le particelle fondamentali della materia in un altro modo, una di calcio con una di ossigeno in un alternarsi geometrico nel nuovo cristallo (il prodotto è solido!), il loro numero totale è rimasto costante (8 atomi). Le cifre delle nostre proporzioni servono a scrivere le formule chimiche (indici) delle sostanze formate: CaO (perciò CaO descrive la molecola dell'ossido di calcio, formata da un atomo di Ca e uno di O)!
Le altre reazioni:
a) Il fosforo bianco con l'ossigeno (vedi
foto nella cartella Photo Gallery) può
formare alcune anidridi (ossidi del non-metallo), frutto della possibilità
di combinazione data dai numeri P:O (massa del fosforo divisa per la massa
dell'ossigeno) = 2:3 (se l'ossigeno a disposizione è poco) oppure
2:5 (reazione con ossigeno in abbondanza ed era il nostro caso) per il
numero degli atomi (per ottenere anche le proporzioni in grammi bisogna
considerare asssolutamente i pesi atomici). Quindi possono formarsi le
molecole P2O3 o il suo multiplo P4O6
e P2O5 (in realtà P4O10).
Questi numeri 2 da una parte e 3 oppure 5 dall'altra indicano quanti atomi
di ogni elemento sono legati all'altro. Nel caso del nostro prodotto stabile
di color arancione abbiamo formalmente 2 atomi di fosforo legati a 5 di
ossigeno, in modo tale che ogni atomo di ossigeno abbia 2 legami garantiti
ed ogni atomo di fosforo 5. I numeri delle proporzioni vengono chiamati
valenze
e sono tabellate nella tavola
periodica in modo da permettere la previsione fondata sulla possibile
formula di un composto, noti gli elementi che lo compongono.
b) L'elettrolisi dell'acqua è l'esempio
classico del lavoro di Lavoisier e Dalton per la facilità dell'esecuzione.
L'acqua, un composto di idrogeno ed ossigeno, viene decomposta negli elementi
di composizione tramite il passaggio della corrente elettrica in una soluzione
contenente un sale (solfato di sodio) oppure acido (acido solforico diluito).
La decomposizione di 87 ml (= 87 grammi, foto) fornisce 29 ml di ossigeno
e 59 ml di idrogeno, perciò un rapporto in volume tra idrogeno ed
ossigeno di 2:1. Questo vale per ogni campione di acqua in qualsiasi luogo.
Poiché per la legge di Avogadro il volume di un gas è proporzionale
al numero delle particelle libere (in perenne moto caotico) che contiene
(tenendo temperatura, pressione e quantità in grammi costanti),
il numero di particelle d'idrogeno è doppio rispetto a quelle di
ossigeno e la formula dell'acqua si spiega così come H2O
ovvero 2 atomi d'idrogeno legati a un atomo d'ossigeno. Se consideriamo
il peso dei volumi di gas, le cose cambiano: abbiamo un rapporto in peso
di 8:1 in favore dell'ossigeno. Se la formula fosse HO, come pensava Dalton
nel 1808 circa, allora il peso atomico relativo dell'atomo d'idrogeno è
1 e quello dell'ossigeno sarebbe 8. Considerando il rapporto dei volumi
dei gas, la proporzione in peso di 8:1 per l'ossigeno proviene dal fatto
che il peso atomico realtivo dell'ossigeno è 16 rispetto a quello
dell'idrogeno e 16:2 = 8:1 !
 |
|
 |
|
|
|
PREVIOUS |
|
PHOTO GALLERY |
|
Last updated: Feb 2002!