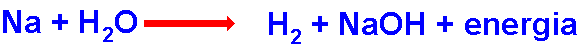Seminario
sui Segreti delle Trasformazioni della Materia
REAZIONI
CHIMICHE: DIMOSTRAZIONI
alcune
reazioni chimiche dal repertorio degli alchimisti medioevali
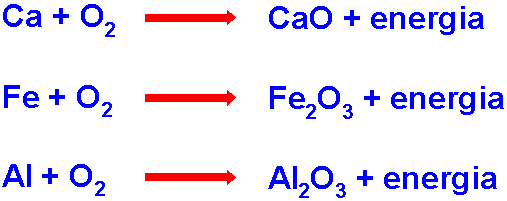
Il flogistone si rivela:
metalli
(rame,
calcio, alluminio, ferro) + ossigeno danno reazioni che mostrano
liberazione di fuoco, combustione, formazione di ossidi! Fu
G. E. Stahl
a introdurre con convinzione nel XVII secolo la teoria del flogistone
(quintessenza o pietra filosofale che unisce i 4 elementi dando le proprietà
finali al loro prodotto, idea di antica origine cinese in vero) per spiegare
i fenomeni in cui la liberazione di energia oppure gas era visibile. Lavoisier
fu il primo a dimostrare che l’ossidazione dei metalli con l’ossigeno risulta
in un aumento di peso degli ossidi prodotti, con liberazione di energia.
Ciò mise fine alla logica del flogisto! Alcune reazioni tipiche
da laboratorio:

Nella foto si vede la reazione della
polvere
di ferro in un provettone contenente ossigeno puro. Scaldato
il sistema fino alla temperatura d'infiammazione, scatta la reazione che
poi libera talmente tanta energia all'interno da fondere il ferro in goccioline
e rompere il vetro!
Non-metalli (zolfo,
fosforo bianco, fosforo rosso) + ossigeno: formazione di anidridi, energia!
Il fosforo bianco,
ottenuto nel 1669 dall'alchimista tedesco Henning Brand a partire
da fosfati ottenuti dall'urina (altrettanto reattivo è il
fosforo rosso), possiede una grande affinità per l’ossigeno. Brand
stesso se ne accorse di persona allorché, raggiante, volle festeggiare
la scoperta mostrando alla propria famiglia il pezzetto di fosforo bianco,
appena isolato, nel palmo della mano: il solo soffio del suo fiato accese
la reazione ustionandogli la pelle!


Si può sfruttare
per queste reazioni anche l'ossigeno presente in sostanze ossidanti cristalline
come il clorato di potassio. Il miscuglio di pochi milligrammi di fosforo
rosso e clorato di potassio impacchettati strettamente in una pillola di
carta alu viene acceso da una martellata. Si sente l'esplosione, mentre
la fiammata è minima, viste le quantità usate (foto sopra).
I metalli alcalini
(litio,
sodio, potassio) reagiscono nell’acqua liberando « aria »
e fuoco! Gli elementi, Li, Na e K sono diversi nel nome e nella massa
atomica, ma simili tra di loro per aspetto e proprietà chimiche.
Vanno conservati sotto olio minerale poiché reagiscono volentieri
con l'acqua o l'umidità:
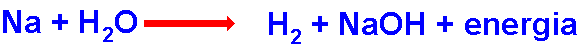

La reazione (foto
sopra) libera calore che fonde il metallo tenero e forma una goccia
di sodio liquido, meno densa dell'acqua, che oltre a galleggiare si
muove come una trottola a causa dello sviluppo di gas dalla sua superficie
inferiore. Il pezzo di carta assorbente serve a bloccare il sodio e provocare
l'accensione per mostrare la tipica fiamma gialla di questo elemento!
Si formano idrogeno gassoso, lo ione negativo idrossido HO- e
quello positivo del Na+ (evaporando l'acqua si otterrebbe
idrossido di sodio cristallino, NaOH), mentre la molecola d’acqua viene
così spezzata durante questa reazione. La reazione del litio è
uguale chimicamente, ma meno violenta, invece, il potassio è più
reattivo e si accende subito in una fiammella viola.
Metalli e non metalli
presentano un potenziale di reazione: alluminio e bromo. Una pallina
di carta alu viene immersa nel bromo liquido. Dopo un minuto di attivazione
parte la reazione che mostra un fuoco infernale nel denso liquido velenoso,
tra i fumi puzzolenti di bromo (gr.: bromos = fetore). L'energia liberata
è talmente elevata da trasformare la pallina di alluminio in una
biglia di fuoco! Il prodotto della reazione è un solido nero e si
scioglie nel bromo. Per rigovernare si fa uso di una soluzione di tiosolfato
di sodio che trasforma il bromo elementare (velenoso!) in bromuro (atomi
di bromo con la carica elettrica negativa).


Lampi sotto l’acqua:
acido solforico, alcol etilico + permanganato di potassio. Aggiungendo
alcol etilico sopra uno strato di acido solforico concentrato si ottiene
un sistema a due fasi a causa della diversa densità. Ora, cristalli
di permanganato di potassio introdotti nel provettone vengono
decomposti dall'acido per formare l'ossido volatile ed instabile Mn2O7
che inontrando lo strato superiore di alcol, una sostanza organica ossidabile,
reagisce scaricando l'energia in lampi accompagnati da crepitii sotto la
superficie del liquido.

Scoperto il segreto
del flogistone (la quintessenza), si passa alla trasmutazione: rame + "acqua"
per avere argento! Introducendo una lamina di rame in una soluzione
"magica" (nitrato d'argento) si decompone il rame per formare argento cristallino
sulla lamina stessa: la tanto ricercata "trasmutazione dei metalli" da
parte di generazioni e generazioni di alchimisti (l'ultima dimostrazione
pubblica di queste trasformazioni si ebbe in Europa nel XVIII secolo!).


La chemioluminescenza
(emissione di luce fredda). Il miscuglio complesso delle sostanze organiche
del luminolo,
della formaldeide
e del pirogallolo,
attivate con alcune basi (carbonato di calcio, soda caustica) e decomposte,
in fine, tramite aggiunta di acqua ossigenata)
subisce una serie di trasformazioni che liberano gas (ossigeno prima, anidride
carbonica ed azoto poi) e trasferiscono l’energia liberata dalle reazioni
in calore e in luce. L’energia di reazioni chimiche non deve finire
sempre in esplosioni (tralascio le equazioni che sono numerose e ancora
non del tutto chiarite), ma le foto sono spettacolari:



L’ossigeno gassoso
nascente emette luce rossa particolare (foto a sinistra), mentre
l'intruglio è di color marrone alla luce del sole (foto in mezzo)!
Dopo l’ossigeno c’è una breve pausa e tocca alla molecola organica
del luminolo emettere luce azzurra (foto a destra), mentre si innesca una
schiumata per la formazione di gas (anidride carbonica, ossigeno ed azoto):
il tutto sembra la lava azzurra di un vulcano diabolico (la foto finale
la prossima volta)!
Il vulcano: la decomposizione
termica del dicromato d’ammonio di color arancione, acceso con alcol ed
ovatta. La liberazione di energia e gas (azoto) rende l'immagine di
un vulcano, con detriti di Cr2O3 di color
verde che schizzano in giro.

Ci sarebbe il carosello dei colori,
per finire, ma lo dobbiamo ancora costruire !!